珪藻トピック (2014年10月7日掲載)
第6回:珪藻はいかにして海水からCO2を取り込んで光合成するか?
- ■はじめに
- 珪藻は地球上のCO2固定の20%程度を担う生物だと言われていますが、ひとえにCO2固定と言っても、陸上と水中でそのプロセスは随分と違っています。また、陸上でも水中でも光化学系やカルビン回路などの酸素発生型光合成機能の必須な働きは、概ね保存されているのに対して、カルビン回路までCO2を送り届ける仕組みは極めて多様です。例えば、一部の熱帯原産の陸上植物や水生植物ではカルビン回路の前段階でCO2を一度C4有機酸に仮固定してからCO2固定化酵素であるRubisCO近傍でC4有機酸からCO2を脱離する、いわゆるC4代謝系を有しますが、この代謝系にも種によって多くのバリエーションがあります。このような代謝は実質的にC4化合物を数mMオーダーに蓄積する為、生化学的なCO2濃縮機構(Biochemical CCM)と呼ばれています。一方、水中でのCO2獲得はガス分子のCO2を相手にする陸上とは異なり、溶存体の無機炭素が基質になります。水に溶存するCO2濃度は大気圧に比例して変化し、常温・常圧では10~15μM程度しか溶けません。難儀なことに多くのI型RubisCOのCO2に対する親和性では、十分な固定反応を機能させるために、50μM以上CO2を必要とし、水中ではそれに遠く至りません。特に海洋はそのアルカリ度と塩度の高さから、より厳しいCO2欠乏環境です。水中の、特に微細藻類やシアノバクテリアはCO2やその水和体であるHCO3-を積極的に取り込み蓄積する代謝を進化させることにより、適応しています。このような代謝系を生物物理的なCCM(Biophysical CCM)と呼んでいますが、この仕組みも最近実に多様であることが示唆され始めています。珪藻類は海洋環境で旺盛な光合成を示すわけですが、珪藻のCCMには諸説があり、C4系代謝も内包しているという説もあります。昨今このようなトピックにも、分子レベルでの解析から色々な考察が可能になってきましたが、今回はその一端を紹介したいと思います。
|
- ■CCMの進化
- そもそも数多のCCMは何時・何故に進化したのでしょうか? Biochemical CCMは、高等植物の陸生化に伴う、乾燥へ対抗するための進化だったと考えられています。一方で、Biophysical CCMは珪藻だけでなく多くの微細藻が獲得した機能ですが、3~4億年前、石炭紀における大気CO2の急激な減少が進化の引き金になったと考えられます(図1)。基本的にそれぞれの藻類の進化が成立した後に獲得されている機能であるため、そのメカニズムも様々な起源のものを取り込んだり転用したりしている、典型的な収斂進化の賜物と考えられます。珪藻類を含むクロミスタに至っては石炭紀より後の2億5千万年前に現れ始めた最も新しいCCM生物の一群と考えられますが(図1)、その後、細胞のサイズ及び葉緑体の形態を、大陸移動に伴う生育環境の多様化に合わせて多様化させてきた生物と考えられます。CCMについてもある程度の多様性を有しているものと考えられます。
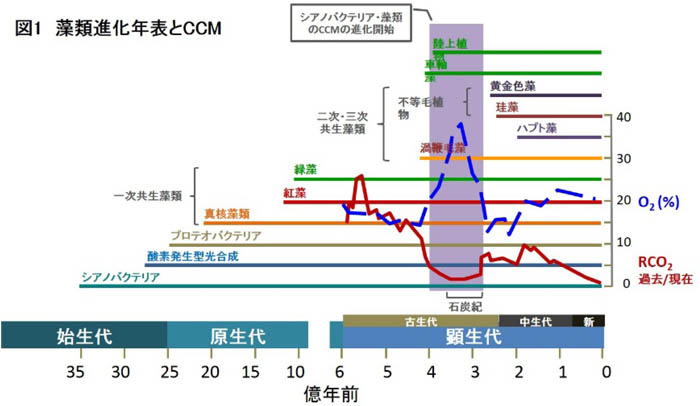
|
■珪藻CCMの基本因子
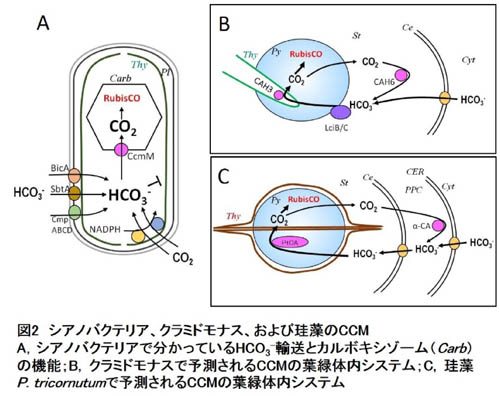
さて、Biophysical CCMにはシアノバクテリアや緑藻クラミドモナスなどで機能同定されてきた幾つかの因子があります。それらは主にHCO3-輸送体、CO2輸送機構、および炭酸脱水酵素(CA)ですが、これまでに、これら因子にCCM生物間で系統性はほとんど発見されていません。シアノバクテリアでは細胞膜上の3種のHCO3-輸送体(BicA,
SbtA, CmpABCD)がHCO3-を細胞内に輸送し、チラコイド膜上に存在するCO2→HCO3-変換装置(Ndh-Chp複合体)が細胞質中のCO2をHCO3-に変換し、こうして蓄積されたHCO3-はカルボキシゾームに浸入する時に、カルボキシゾーム殻に存在するCAによってCO2に脱水されてRubisCOに固定されます(図2A)。シアノバクテリアでは、CAを細胞質に強制発現させると、細胞質でCO2を生成してまい、CCMを行えなくなることが分かっています。CAがカルボキシゾームのような特定部位に厳密に局在していることが重要であることがわかります。一方、真核生物のBiophysical
CCMはシアノバクテリアほど分かっていません。緑藻では形質膜上のHCO3-輸送体(Lci1)やおそらく葉緑体包膜上のHCO3-輸送体が葉緑体への無機炭素の濃縮を行い、RubisCOが局在している葉緑体内顆粒であるピレノイドでCO2の生成を行っているものと考えられます。このとき、チラコイド膜内に局在するCA(CAH3)がCO2の局所的生成にかかわり、ストロマのCA(CAH6)とその他の因子がピレノイドからのCO2漏れ出しを防いでいると考えられています(図2B)。 |
| 珪藻ではゲノムが最初に読まれた羽状目と中心目の2種(Phaeodactylum tricornutumおよびThalassiosira pseudonana)において、Biophysical CCM因子の機能が研究されています。珪藻には哺乳類のsolute carrier (SLC)タンパク質ファミリーをコードする輸送体遺伝子が多く存在しており、例えばP. tricornutumゲノムには哺乳類でHCO3-を輸送するとされるSLC4およびSLC26のホモログ因子が少なくとも10個存在しています。このうちの1つ、PtSLC4-2はすでに細胞膜に局在することが報告され、このHCO3-輸送体としての機能も同定されています。 |
 |
PtSLC4-2はHCO3-を特異的に輸送し、海水のpHである8.2程度で最も高い活性を有します。また、Na+に特異的な依存性を示すことから、HCO3-のカウンターカチオンとしてNa+を共輸送する可能性が示されています。珪藻で同定されているHCO3-輸送体は現在PtSLC4-2のみですが、これ以外のSLC4およびSLC26型タンパク質も形質膜あるいは葉緑体包膜で機能していると考えられ、今後の解析が期待されます。
細胞内およびストロマ内に送り込まれた無機炭素はpHによってCO2やHCO3-に平衡が傾きます。最終的にピレノイドのRubisCOで固定されるのはCO2のみですから、ピレノイドの中ではCO2を発生させなければなりません。しかしCO2は、ほぼ無極性な分子あることから、極めて膜透過性が高く、場合によっては、せっかくエネルギーを使って溜め込んだ無機炭素を無益に細胞外に漏らしかねませんので、細胞の至るところで発生させるわけにはいきません。つまり、Biophysical
CCMというのは無機炭素を取り込むと同時に、CO2の発生場所を厳密に制御するための収斂進化と言えます。CAは無機炭素の平衡速度を制御する地上で最も速い酵素です。この酵素が適所に局在することが、細胞内無機炭素流路を整理し、Biophysical
CCMの効率を左右すると考えられます。これは、上にも触れたシアノバクテリアの細胞質にヒトCAを強制発現させた実験結果が証左になっています。 |
- さて、珪藻のCA局在ですが、P. tricornutumのゲノムには少なくとも9種のCA遺伝子(α型5、β型2、およびγ型2)があります。一方、T. pseudonanaゲノムにはα型3、γ型5、δ型4、ζ型1の計13のCA遺伝子が存在します。ゲノム株種の間でも相当の多様性があることが窺い知れます。これらの局在はほぼ決定されており、P. tricornutumでα型はすべて葉緑体4重包膜系、β型はすべてピレノイド、γ型はすべてミトコンドリアに局在します(図3)。一方、T. pseudonanaの場合、細胞外にαとζ型2種、細胞質にγ型1種、ミトコンドリアにα・γ合計4種、葉緑体包膜系とストロマにα型それぞれ1種、局在が決定しています。現時点で細胞外、細胞質、ストロマ、およびピレノイドにおけるCA局在に、両細胞間で大きな違いが見られており(図3)、やはり珪藻CCMの多様性を強く示唆しています。
P. tricornutumの場合、この局在から考えられるモデルは、細胞外のHCO3-を積極的に取り込み、そのまま、葉緑体包膜系のHCO3-輸送体でストロマに送り込み、ピレノイドで局所的にCO2を発生させるというものです(図2)。このとき葉緑体包膜系のCAはおそらく葉緑体から漏れ出してくるCO2を再びHCO3-輸送体に渡す役割があると我々は考えています(図2)。
|
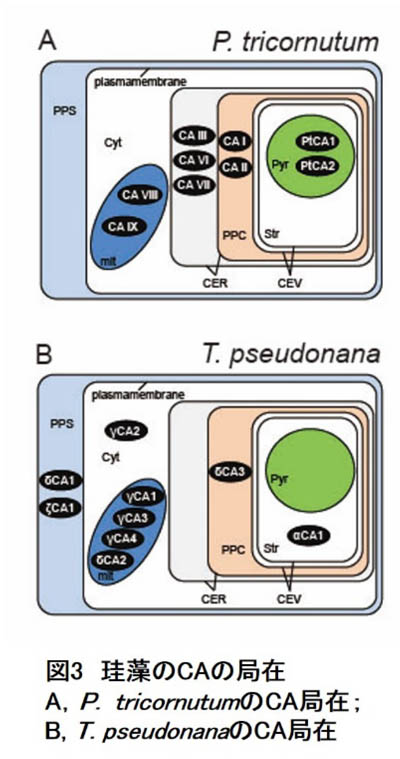 |
| 一方、T. pseudonanaは細胞外でCO2を発生させ、これを拡散で取り込みながら細胞質のCAが葉緑体包膜系のHCO3-輸送体に渡しているのではないかと考えています。CO2はストロマ全域で発生すると考えられ、これら2種の海洋性珪藻で全く違うモードのCCMが働いているものと考えられます。しかし、葉緑体包膜系がCO2漏れ出しのバリアとして機能するのはどちらにも共通している可能性があり、今後の解析が待たれるところです。 |
- ■珪藻におけるBiochemical CCMの可能性?
- 2000年にプリンストン大学のグループが海洋性中心目Thalassiosira waissflogiiで機能的なC4型光合成経路の存在を報告し、その後、この種ではBiophysicalとBiochemicalなCCMが併存していると報告しています。しかしながら、生理学的なレベルでC4の証拠がある程度認められている種はT. weisflogiiのみであり、このようなハイブリッド型CCMの珪藻における一般性には疑問符が付けられています。最近、分子レベルでクラシックなC4代謝系必須酵素の局在を決定したデータがT. pseudonanaで得られており、HCO3-固定酵素である2つのホスホエノールピルビン酸カルボキシラーゼ(PEPC)はミトコンドリアと葉緑体包膜系に、脱炭酸酵素になり得るホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)もミトコンドリアに局在しました。もう一つの脱炭酸酵素であるリンゴ酸酵素(ME)は細胞質に局在しており、ストロマで機能し得るC4脱炭酸酵素は見つかっていません。P. tricornutumにおいてもPEPC、PEPCK、およびMEの配列と局在は極めてよく保存されており、少なくともクラシックなC4経路が機能するような局在ではありませんでした。多様な収斂進化が見て取れる珪藻のBiophysical CCMとは対照的に、これらC4系酵素の遺伝子配列や局在には目立ったバリエーションはないことから、珪藻におけるC4有機酸代謝系は、珪藻類の多様な適応放散が起こる前に確立されたハウスキーピングなものであることが示唆されています。おそらく、TCA回路およびアミノ酸代謝系の維持に多くの機能果たしているものと考えられます。
では、T. weissflogiiのように、Biophysical CCMに加えてC4のようなBiochemical CCMの併存を必要とする要因は何なのでしょうか?一つの可能性として、珪藻細胞のサイズの多様性があげられます。珪藻は大きなものではミリメートルオーダーのものがあり、中心目では細胞サイズが大きくなると、高等植物のように葉緑体数もそれに比例して増えます。Biophysical
CCMが効果的に機能するには、漏れ出してくるCO2を効果的にトラップしてストロマ内に戻さなければなりません。T. pseudonanaでは細胞質CAもCO2のトラップに関与している可能性があり、無機炭素をため込むような機構は、細胞の体積が増えるほど、反応の可逆性と拡散律速に阻まれて効率を失う可能性が考えられます。その点、有機酸に仮固定する方式は、一度作られた有機酸はどこかで使われるまで基本的にとどまってくれるため、大きな細胞のCCMとしては有利な仕組みかもしれません。
|
- ■おわりに
- CO2は植物生産にとって最重要な基質であると同時に、光エネルギーに対する最大のシンクと言って良いでしょう。水圏では、HCO3-も加わって実質的にCO2と同様の重要な生理的役割を負います。珪藻類において、これら溶存無機炭素を取り込む仕組みと、そこに関わる分子は、かなり多様であると考えられますが、いずれ分子機構が明らかになってきたらCCMのモードはいくつかのパターンに類型され得るでしょう。見過ごされがちですが、海水から無機炭素を取り込む過程は光合成の効率を左右する重要なステップです。珪藻のCCMひいては光合成のモードがどのような比率で海洋表層に混在しているかなど、海洋観測などにも簡便に利用できるような知見や技術に発展することも含め、期待を持って研究をしています。
|
- ■引用文献
- 松田祐介、中島健介、菊谷早絵 海洋性珪藻の炭素固定機構-海洋の食物生産を維持・制御するメカニズム- 化学と生物 2014 52(8) 519-529
- l Yusuke Matsuda, Peter G. Kroth (2014) Carbon fixation in diatoms. In Martin Hofmann-Marriott Ed. The Structural Basis of Biological Energy Generation
, Advances in Photosynthesis and Respiration, The Structural Basis of Biological Energy Generation Volume 39, Chapter 18, 2014, pp 335-362, Martin Hohmann-Marrio
tt Ed. Springer, DOI: 10.1007/978-94-017-8742-0_18
|
松田 祐介(Yusuke MATSUDA)
関西学院大学理工学部生命科学科
生物機能基材研究開発センター
教授
研究テーマ
- 海洋性珪藻類の無機炭素取り込み機構、CO2感知機構
- 珪藻類のピレノイド構造と機能の解明(炭酸脱水素酵素とRubisCO周辺の生化学)
- シリカバイオミネラリゼーションによる生物機能基材の開発
|

 |
*本ページの文章・図・表など,全ての著作権は筆者および日本珪藻学会に帰属いたします。無断転載・引用を固く禁じます。
Yesterday: 1
Today: 1




